氧化还原反应核心概念解析
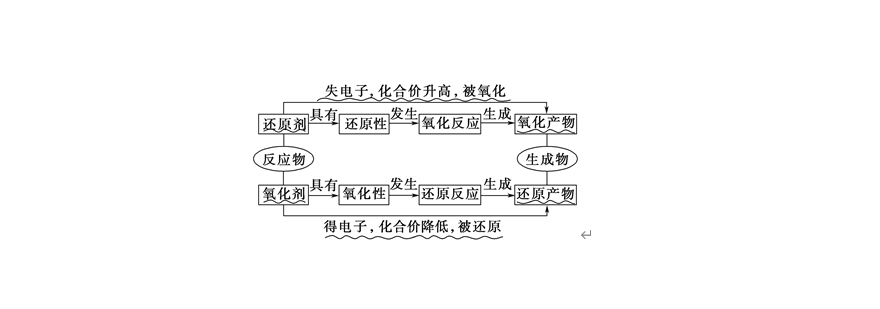
理解氧化还原反应需把握电子转移本质特征。当物质间发生电子得失或偏移时,伴随化合价升降现象。具体表现为:
| 反应类型 | 电子变化 | 化合价变化 |
| 氧化反应 | 失去电子 | 升高 |
| 还原反应 | 获得电子 | 降低 |
五大核心规律深度剖析
电子守恒定律应用
在MnO₂与浓盐酸反应中:
MnO₂ + 4HCl(浓) → MnCl₂ + Cl₂↑ + 2H₂O
通过电子守恒可证:
Mn元素得电子数 = Cl元素失电子总数
反应强弱判断准则
比较不同情境下的物质氧化性/还原性强度,需注意:
① 同浓度下不同物质的反应活性差异
② 特定介质条件对物质性质的影响
③ 温度变化对反应方向的调控作用
配平技巧实战演练
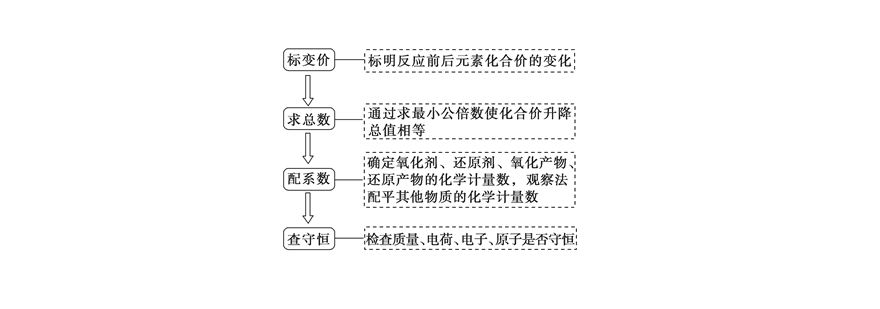
酸性环境配平步骤
以KMnO₄与FeSO₄的硫酸溶液反应为例:
1. 标定变价元素:Mn(+7→+2),Fe(+2→+3)
2. 建立电子守恒关系
3. 补充H⁺和H₂O平衡电荷与原子
碱性条件注意事项
处理ClO⁻与Cr(OH)₄⁻反应时:
① 避免直接引入H⁺
② 用OH⁻调节电荷平衡
③ 通过H₂O补充氧原子
典型错误案例分析
| 常见误区 | 正确理解 | 示例说明 |
| 单纯以化合价变化判断物质性质 | 需结合具体反应环境 | 浓/稀硝酸与金属反应产物差异 |
| 忽略介质对反应方向的影响 | 酸性/碱性条件需分别处理 | KMnO₄在不同pH下的还原产物 |
学习效果检测体系
通过三阶检测确保知识掌握:
① 基础概念诊断测试(30分钟)
② 配平技巧专项训练(50分钟)
③ 综合应用题实战演练(90分钟)








